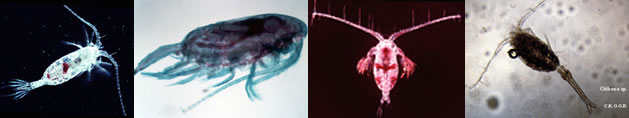
|
|
 |
| Monstrillidae Dana, 1849 | | Ref.: | Giesbrecht, 1892 (p.80); Malaquin, 1901 (p.106); van Breemen, 1908 a (p.201, spp. Key); Sars, 1921 (p7); Rose, 1933 a (p.338); Sewell, 1949 (p.131, Rev., Key); Davis, 1949 a (p.245, Rev., genera & species Key); Razouls, 1972 (p.147); Davis & Green, 1974 (p.62); Isaac, 1974 (p.127); 1975 (n°144/145, p.2, genera key.); Kabata, 1979 (p.84); Razouls, 1982 (p.747); Bowman & Abele, 1982 (p.13); Zheng Zhong & al., 1984 (1989) (p.272); Huys & Boxshall, 1991 (p.154, 422, Rem.); Grygier, 1994 (p.235, 240-241); 1994 a (p.23); 1995 (p.245, 247, Rev.); 1995 a (p.1, Rev.); Chihara & Murano, 1997 (p.1002); Boxshall & Halsey, 2004 (p.16; 835: Def.; p.837: Genera key; Rem.); Grygier & Ohtsuka, 2008 (p.460, Rem.: New genus); Vives & Shmeleva, 2010 (p.156, Rem., Genera key); Suarez-Morales, 2011 (p.4, 8, Rem.: Rev.); Suarez-Morales & al., 2017 (p.1827, Rem.); Jeon & al., 2018 (p.45, 47: genus new, p.56-57: genetic divergences, phylogenetic trees), Rem. p.61 on Haemocera; hosts vs monstrilloid species) | | Rem.: | 8 Genres ont été plus ou moins bien définis: Haemocera, Cymbasoma, Monstrilla, Monstrillopsis, Thaumaleus, Strilloma, Thaumatohessia, Caromiobenella.
Sewell (1949) donne les caractères généraux de 4 genres (Table, p.132). Davis (1949 a) met en synonymie d'une part Thaumaleus (au sens de Giesbrecht,1892, non Kröyer,1849) et Cymbasoma, d'autre part Monstrilla et Monstrillopsis.
Isaac (1975), dans les fiches d'identification du zooplancton (Feuilles 144/145), classe les espèces dans 5 genres: Monstrilla, Monstrillopsis, Thaumaleus, Thaumatohessia, Strilloma.
Huys & Boxshall (1991,154) n'en admettent que 3: Monstrilla, Thaumaleus, Monstrillopsis.
Grygier (1994) démontre l'identité entre Monstrilla Dana, 1849 et Thaumaleus Kröyer,1849; l'antériorité revenant à Monstrilla.
Dans l'attente d'une redéfinition plus correcte des genres, je n'ai tenu compte dans la compilation des espèces par genre que ce qui m'a semblé le mieux établi.
Grygier (1995 a, p1-82) fournit une synthèse bibliographique et un index des espèces et de leurs citations par les divers auteurs, avec remarques sur des synonymes. La description sommaire de l'espèce type Haemocera danae ne permet pas de retenir cette forme. De plus de nombreuses espèces sont mal décrites d'où des confusions synonymiques possibles.
Le maintien du genre Strilloma est discutable compte tenu de la qualité des illustrations. Type : Strilloma longa Isaac,1974. Suarez-Morales & Gasca (2004, p.292) confirment l'invalidité de ce genre.
La famille comprend actuellement (2004) 3 genres: Cymbasoma, Monstrilla, Monstrillopsis, plus une forme inclassable Thaumatohessia. D'après Grygier & Ohtsuka (2008, p.460), seulement 4 genres sont considérés actuellement comme clairement valides: Cymbasoma, Maemonstrilla, Monstrilla, Monstrillopsis. Pour Suarez-Morales (2011, p.4) 116 espèces sont recensées, 56 appartiennet au genre Monstrilla, 41 à Cymbasoma, 12 à Monstiloopsis, et 7 au récent genre Maemonstrilla, 10 autres espèces assigneées à un genre ou de validité douteuse demeurent de placement incertain.
Les formes constituant cette famille montrent un mode de parasitisme provisoire parasitisme protélien (du grec pro: avant et teleios: adulte). A l'état adulte, ces formes sont bien différenciées pour la vie pélagique, à nage rapide. Elles possèdent un oeil nauplien et de robustes quatre paire de pattes thoraciques. Le dimorphisme seuel est accentué, le mâle étant plus petit que la femelle. Le tube digestif est atrophié et réduit à un mince cordon non fonctionnel. La tête et le thorax ne présente plus que les antennules, les appendices buccaux et les maxillipèdes ont disparus. Ainsi l'animal ne se nourrit pas et n'a plus qu'un rôle de reproducteur.
La particularité de ces organismes est qu’ils sont parasites pendant toute leur croissance comme l’avait constaté Giard (1896)sur une forme (Thaumaleus) parasite interne d’une Annélide Polydora giardi. D’autres Monstrillides ont été trouvés depuis, parasite dans des Syllidiens et des Salmacines. Malaquin reconnaît que que ce sont de véritables parasites internes (contrairement à l’opinion de Giard), localisés dans le système vasculaire de l’h-ote (sans communication avec l’extérieur) et ne sortant qu’à l’état adulte (d’où l’absence de formes juvéniles lors des pêches planctoniques).
Le cycle du développement a été suivi par Malaquin, 1901) sur haemocera danae) parasite des Salmacines. L’œuf se développe jusqu’au stade nauplius dans un sac ovigère fixé sur deux épines ovigères postérieures du segment génital de la femelle libre. Le nauplius est dépourvu de tube digestif et sa troisième paire d’appendices est réduite à une paire de crochets. Il nage activement, puis pénètre à travers le tégument dans une salmacine ; il mue alors, rejetant tégument et appendices et se réduit (comme dans le cas de la Sacculine) à un amas cellulaire indifférencié. Sous cette forme, il parvient (sans doute par cheminement amiboïde) dans le vaisseau longitudinal ventral de l’Annélide. Là il s’entoure d’une cuticule chitineuse.
Ce stade présente une forme allongée enclos dans un fourreau chitineux et développe à son extrémité antérieure deux lobes inarticulés qui s’allongent en deux longs appendices intravasculaires, jouant le rôle d’appendices absorbants du sang de l’hôte. Chez les espèces parasites des Polydores et des Syllis, il n’y a qu’une paire de ces appendices ; chez Monstrilla danae des Salmacines, il y en a deux ; Haemocera danae en possède trois paires inégalement développées ; Chez Monstrilla helgolandica Claus, 1863, parasite du Gastéropode Odostomia rissoides trouvé et étudié par Pelseneer, la présence de trois paires de tentacules est constante (d’où la tentation d’en déduire que ces formations sont homologues des appendices naupliens comme l’affirme Malaquin, ou des formations adaptatives totalement nouvelles. La signification morphologiqe de ces appendices reste à élucider).
La première cuticule chitineuse formée autour du parasite est rejetée et remplacée par une autre, qui formera une enveloppe extensible, persistant tout le reste du développement ; elle est garnie postérieurement de rangées de petitesépines et cconstitue le fourreau qui appartient en propre au parasite et a vraissemblablement la valeur morphologique d’une mue. Se nourrissant par absorption, au moyen des appendices antérieurs, l’adulte se différencie progressivement avec tous ses organes et appendices et ses glandes génitales. Une fois complétement formé, il brise la cuticule larvaire et sort de l’hôte où iles deux sexes mènent une vie pélagique. Bien que sexuellement mûr, ce stade libre doit être qualifié de préadulte car une mue supplémentaire intervient. Les mâles et les femelles sont dépourvus des appendices céphaliques à l’exception des antennes et d’une trace buccale, ce qui leur confère un habitus caractéristique. Leur durée de vie dans le milieu, généralement côtier et littoral (du fait des localisations benthiques de leurs hôtes) est encore inconnue.
Le développement larvaire des Thespesiopsyllidae est moins connu que celui des Monstrillidae. Les observations de Bresciani et Lützen (1962) réalisées sur Thespesiopsyllus paradoxus (Sars, 1921), parasite de l’Ophiure Ophiopholis aculeata montrent que les modalités du cycle sont différentes de celles d’Haemocera danae. Le stade métanauplius à quatre paires d’appendices vivant dans l’estomac de leur hôte. Ces larves muent pour donner un copépodite qui sort de l’Ophiure par la bouche pour mener une vie libre. Le nombre de stades qui séparent ce cvopépodite de l’adulte est inconnu.
Jeon & al. (2018, p.47) établit à 6 le nombre de genres suite à la création du nouveau genre Caromiobenella de Corée. Ces auteurs soulignent le fait que le nombre des soies caudales sont variables dans le genre Cymbasoma et ne peuvent ainsi être utiliser pour caractériser les genres.
D'autres invertébrés (Plathelminthes, Nematodes, Crustacés) ont des membres à cycle de vie protélienne, mais parmi les Copépodes, seuls les monstrilloides et thaumatopsyllioides résentent ce type de cycle. Une récente analyse phylogénétique (Huys & al., 2007) ont suggéré qu'il existe un ectoparasite commun ancêtre des monstrillides et des caligides, et que ces lignées ont divergées par partage des hôtes; lors de ce processus les monstrillides sont devenus parasites des invertébrés, versus vertébrés pour les hôtes des caligides, acquérant des nauplli modifiés, perdant leur appendices buccaux, tandis que les stades larvaires devenaient endoparasites, les adultes devenant libres afin de se reproduire et assurant une dispersion.
Comme le souligne le spécialiste de cette famille (Suarez-Morales, 2011, p.7), la biogéographie des espèces est plus que contestable, et moins que sûre du fait des imprécisions des diagnoses comme des figures, à l'exception des quelques publications anciennes et d'auteurs spécialistes de ce groupe. Ainsi dans la base de données de l'Observatoire Océanologique de Banyuls, il faut entendre que celles-ci sont plus par recensement et information que par certitude, aux exceptions heureusement assez nombreuses. |  issued : A. Raibaut in Traité de Zoologie. Crustacés, VII (2). Edit. Masson, 1996. Copépodes. II. Les copépodes parasites. [p.691, Fig.245]. Biological cycle of Haemocera danae (Claparède, 1863) [drawing by the author (1985) after Malaquin, 1901]. A, free naulius; B, nauplius going acrross integument of the annelid host; C, naupliar cells mass; D-G, four stages of naupliar development; H, parasitic terminal stage female; I, free adult female; J, parasitic terminal stage male; K, free adult male with spermatophores. |
 Issued from : R. Huys & G.A. Boxshall in Copepod Evolution. The Ray Society, London, 1991. [p.154, Table 3]. Comparison of the Monstrillidae and Thespesiopsyllidae [= Thaumatopsyllidae]. Nota: The family Thespesiopsyllidae is transfered in the new order Thaumatopsylloida by Ho, Dojiri, Hendler & Deets, 2003. |
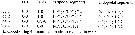 Issued from : G.A. Boxshall & S.H. Halsey in An Introduction to Copepod Diversity. The Ray Society, 2004, No 166, Part. II. [p.835]. Armature formula of swimming legs P1 to P4. Main morphological characters in the family: - Rostrum absent. - Nauplius eye present, sometimes elaborate with large miror surfaces. - A1 anteriorly directed, indistinctly 4-segmented in female, sometimes annulate distally; setal nomenclature system devised by Grygier & Ohtsuka (1995: Fig.6). Malme A1 geniculate, 4 to 5-segmented with 1 segment distal to geniculation. - A2, Md, Mx1 and Mx2 all absent in adult of both sexes. - Oral opening conical, located on ventral surface of cephalothorax of adult. - Prosome comprising cephalothorax, incorporating first pedigerous somite, and 3 free pedigerous somites to 6 setae; 1 to 3 free abdominal somites. Swimming legs 1 to 4 biramous, with 3-segmented rami; Legs 1 to 4 with intercoxal sclerites; inner seta on basis of P1 absent, inner coxal setae absent. - Urosome 4 to 5-segmented in male, with 2 free abdominal somites. - Genital apertures fused into large median, ventral aperture in female; paired and ventral in male, sometimes carried near apex of ventral prominence. - Caudal rami with 3 to 6 setae. - |
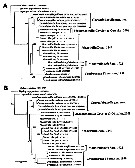 Issued from : D. Jeon, W. Lee & H.Y. Soh in J. Crustacean Biol., 2018, 38 (1). [p.59, Fig. 11]. Phylogenetic trees reconstructed based on the sequences of mtCOI derived from fixe genera and 11 species of monstrilloids including three outgroup taxa, Calanus sinicus (Calanoida), Tigriopus japonicus (Harpacticoida) and Lepeophtheirus salmoni (Siphonostomatoida).
A, Maximum likehood (ML) tree topology.
B, Bayesian inference (BI) tree topology.
Numbers above or below branches indicate bootstrpaping value (BP, in percentage, %) and Bayesian posterior probabilities (BPP, in probability, p) of ML and BI trees, respectively.
Each species name followed by the GenBank accession number (s); the numbers in brackets indicate the data from the other sources while the number for the sequences without brackets were preparated by the current authors. |
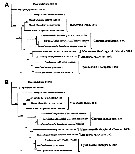 Issued from : D. Jeon, W. Lee & H.Y. Soh in J. Crustacean Biol., 2018, 38 (1). [p.60, Fig. 12]. Phylogenetic trees reconstructed based on the sequences of 28S rRNA derived from five genera and 11 species of monstrilloids including three outgroup taxa, Calanus sinicus, Tigrioipus japonicus, Lepeophtheirus salmonis.
A, A, Maximum likehood (ML) tree topology.
B, Bayesian inference (BI) tree topology.
Numbers above or below branches indicate bootstrpaping value (BP, in percentage, %) and Bayesian posterior probabilities (BPP, in probability, p) of ML and BI trees, respectively.
Each species name followed by the GenBank accession number (s); the numbers in brackets indicate the data from the other sources while the number for the sequences without brackets were preparated by the current authors. |
 Issue de : A. Malaquin in Arch. Zool. Exp. Gen., 1901, 3ème ser., IX. [Pl. II]. Comme Haemocera danae (= Monstrilla danae Malaquin, 1901 (non Claparède, 1863) ? = Cymbasoma rigidum femelle, et Monstrilla anglica mâle. Nomenclature pour toutes les planches (PL. II, III, IV, V): ab = abdomen ab 1,2,3,4 = somites abdominaux. an 1 = antenne antérieure (Antennule, A1). an 2 = antenne postérieure de l'adulte transformée en tentacule (A2). b = bouche. Cd = canal déférent. Ce = céphalon. Cer = cerveau. Cn = cellules nerveuses. Cp = cellules pigmentaires. Ct = cellules amaeboides des tentacules. Ect = ectoderme. End = endoderme. Enp = endopodite. Ep = épiderme; Exp = exopodite. F = Furca [(Non somite terminal = rames caudales)]. Hae mâle, Hae femelle = Haemocère parasite dans l'intérieur de l'hôte. G = initiales génitales. i = invagination ventrale. Lac = lacune sanguine. m = cellules migratrices du mésoderme. M = muscle; M.d = muscle dorsal; M.v = muscle ventral; M.l.d. = muscle latero-dorsal. mdt = mandibule (Md) transformée en tentacule. Més = mésoderme. N. an 1 = antenne antérieure de la larve Nauplius. N. an 2 = antenne postérieure de la larve Nauplius. N. md = mandibule de la larve Nauplius. Oe. l. = oeil lateral. Oe. m. = oeil médian. O. g. = orifice génital. Ov = ovaire. Ovd = oviducte. Pth 1,2,3,4,5 = pattes thoraciques (P1 à P5). Rét = cellules rétiniennes. S = soies. S. g. = soies génitales. Sp. ph. = spermatophore. St = stomodeum. T = testicules. Th = thorax. Th = somites thoraciques.
Vit = vitellus.
Nomenclature particulière à l'hôte (Salmacyna dysteri):
Br = branchies.
C. g. = cavité générale du coelome.
I = intestin.
L. i. = lacune péri-intestinale.
M. th. = membrane thoracique.
Ne = néphridie.
Ph = pharynx.
V = vaisseau; V. v = vaisseau ventral; V. br. = vaisseau branchial.
Malaquin (1901), lors de son étude du parasitisme évolutif des monstrillides, expose l'historique de ce groupe de copépodes marins. Ceux-ci sont libres à l'état adulte dans le plancton, nageant très rapidement, particulièrement les mâles, à des vitesses optimales par rapport aux autres copépodes pélagiques. Ils sont de forme tout à fait remarquable et de taille perceptible. Certains auteurs les ont apparentés aux Corycaeidae, d'autres les considèrent comme une famille autonome apparentée soit à des copépodes semi-parasites, soit à des formes libres. L'opinion qui prévaut est que les Monstrillides rentrent dans le groupe des copépodes libres, par le genre de vie de l'adulte et par leurs caractères morphologiques: forme générale du corps, organes des sens, appendices natatoires.
Malaquin se réfère aux travaux de Giesbrecht (1892) et à la division des copépodes en deux sous-ordres: Gymnoplea et Podopla.
Les podopléopodes, auxquelles appartiennent les Monstrillides, possèdentdes appendices rudimentaires abdominaux, ou pléopodes, situés sur le bord des orifices génitaux, par opposition aux Gymnopléopdes dépourvus de ces appendices. Tandis que chez les premiers, le quatrième et le cinquième segments thoraciques sont toujourd distincts, chez les seconds, ces deux segments sont fusionnés.
Les Podopléopodes comprennent deux sections ou tribus; dans l'une les antennes des mâles sont modifiées en vue de la copulation, c'est la tribuy des Ampharthrandria, le seconde tribu, les Isokerandria, ne présente pas ce caractère. Les Monstrillides appartennent à la première tribu, avec les familles Mormonillidés, Cyclopidés, Harpacticidés, d'où: Ordre des Copepoda avec 2 sous-ordre: Gymnoplea et Podoplea, ce dernier avec 2 tribus: 1- Ampharthrandria (comprenant les Monstrillidae, Mormonillidae, Cyclopidae et Harpacticidae); et la tribu 2: Isokerandria.
La caractéristique différentielle des Monstrillidae par rapport aux autres Podoplea-Ampharthrandria est que les antennes postérieures (A2), les mandibules (Md), les maxilles (Mx1 et Mx2) et les maxillipèdes (Mxp) sont totalement absentes. Il faut y joindre l'absence de rostre et du tube digestif réduit à un stomodeum rudimentaire. Ces caractères sont communs aux deux sexes. Chez la femalle, le sac ovigère unique est porté par un appendice formé de deux longues soies insérées sur la face ventrale du segment génital; chez le mâle, cet appendice génital présente une partie basilaire terminée par deux branches chargées de porter les spermatophores.
Ce groupe de copépode est connu depuis que James . Dana (1848) décrivit ce petit crustacé pélaqiues dans la mer de Sulu, lors de l'expédition dirigée par Charles Wilkes. Kröyer (1848-49) décrivait sous le nom de Thaumaleus typicus (antérieurement figuré sous le nom de Thaumatoëssa, dans l'atlas de Gaimard (1842-1845). En 1857, John Lubbock nota à Weymouth un exemplaire mâle décrit comme M. anglicaClaparède (1863) observe à Saint-Vaast-la-Hougue (Manche) des individus mâles et femelles décrits comme M. danae, puis Claus (1863) décrit M. helgolandica à l'île Helgoland (Mer du Nord). Kriczagin (1877) décrit trois espèces de la mer Noire (M. pontica, intermedia, longissima). Möbius (1884, 1887) signale l'espèce de Claparède (M. danae dans le Kieler Bucht (Allemagne, mer Baltique). I.C. Thompson (1887, 1888) décrivit Cymbasoma rigidum de Ténériffe (ïles Canaries), Cymbasoma Herdmannii de l'île Puffin (SW de l'Irlande) et par ailleurs des exemplaires rencontrés par T. Scott (1889) dans le Firth of Forth (Ecosse, Mer du Nord).
En 1890 Bournedécrit dans la baie de Plymouth Monstrilla longispina, comme d'autres espèces. Giesbrecht (1892) reinstalle le genre Thaumaleus oublié depuis Kröyer, et met au point la biblographie, la synonymie et la diagnose des deux genres et les diverses espèces qu'ils comportent.
Timm (1893, 1894) décrit plusieurs espèces (Thaumaleus Thompsonii, Th. germanicus, Monstrilla helgolandica, M. grandis. Karawaiew (1894) décrit M. Ostroumowii, rapportée ultérieurement au genre Haemocera.
En 1895 et 1896, A. Giard signale le parasitisme du genre Thaumaleus. A. Malaquin crée le nouveau genre Haemocera pour l'espèce type Haemocera danae à partir d'annélides serpuliens Salmacyna dysteri infestés, placés dans des bacs.
La sortie des monstrillides (H. danae) montre que les mâles sont toujours plus nombreux que les femelles.
Morphologie externe :
Le céphalon présente, en avant, chez l'adulte, qu'une seule paire d'appendices, la plus antérieure, les antennules; un orifice ventral très petit , plus ou moins en forme de cône, la bouche et antérieurement sous la cuticule, l'oeil ou plutôt les trois yeux volumineux chargés de pigment. le céphalon se termine antérieurement brusquement, la paroi dorsale tombant ^presque à pic ou étant légèrement arrondie. Dans le cours de l'ontogénèse il a existé un prolongement rostral très développé, lequel a été ensuite résorbé vers la fin de l'évolution parasitaire (Pl. IV, fig.32). Sur la face ventrale, un peu en avant de la bouche et symétriquement, existe deux dépressions (fig.2b) dont la fonction a d'abord été prise par Bourne (1890) comme des rudiments de la seconde paire d'antennes (A2), mais par la suite l'étude des coupes anatomiques laissait à penser qu'il pouvait s'agir de l'orifice de glandes. Ces dépressions de forme irrégiglièrement circulaire, avec des stris concentriques, les autres radiaires, correspondent à l'insertion de deux appendices qui sont tombés au moment de la libération du monstrillide, ces deux appendices sont homologues aux antennes postérieures (A2).
La taille du céphalon, uni au premier somite thoracique, est très différente dans les deux sexes (dimorphisme sexuel apparent). Chez la femelle, le céphalon est beaucoup plus développé que chez le mâle. Cette inégalité tient au développement considérable des ovaires, alors que chez le mâle les testicules n'occupent qu'un volume beaucoup plus restreint, et encore la plus grande partie de cette région est-elle occupée par une musculature puissante, presque absente dans la région correspondante de la femelle. Il résulte de cette disproportion dans le céphalon des deux sexes que le mâle est grêle, élancé, tandis que la femelle a le corps plus allongé, mais aussi plus épais et plus lourd.
Les antennes antérieures (A1) de la femelle sont formées de quatre sgments (ou articles) qui portent des soies courtes et acérées, épineuse, des soies tactiles allongées, des soies semblables avec de minces filaments disposés sur deux rangées et leur conférant un aspect penné, des soies olfactives pénicillées; la répartition de ces différentes formes de soies et leurs dimensions respectives sont figurées (Pl. II, fig. 1, 2, 3). les segments antennaires sont courts et dirigés vers l'avant, et ne présentent que des mouvements de latéralité peu prononcés. Les muscle moteurs qui les actionnent sont insérés sur les parois du céphalon, à droite et à gauche des yeux; ils sont striés, disposés en deux faisceaux principaux qui s'étendent inégalement dans la longueur de l'appendice. Les antennes sont colorées par des amas de pigment jaune ou jaune-verdâtre.
Les antennes antérieures (A1) du mâle sont proportionnellement plus longues que celles de la femelle et présentent cinq segments, plus riches en soies que chez les femelles. Elles présentent une modification qui consiste en une adaptation de cet appendice pour la fonction préhensile, lors de la réunion des sexes. Chez Haemocera danae, le dernier segment est plus long que le précédent et aussi plus grêle, pouvant se recourber jusqu'à l'angle droit, formant ainsi une sorte de pince géniculée. Ce segment est terminée par une forte soie placée dans le prolongement même de l'antenne, destinée à faciliter la préhension.
La bouche est un orifice ventral situé en avant du céphalon; elle correspond à une légère dépression de la cuticule et son diamètre est très petit, non protégée par des lèvres, ni entouré par des appendices masticateurs. La petitesse même indique que c'est là un orifice non fonctionnel.
En arrière, le céphalon se prolonge, par le premier somite thoracique, avec lequel il est soudé. Chez le mâle, le corps va régulièrement en se rétrécissant jusque vers l'insertion de la première paire de pattes thoraciques; chez la femelle, le céphalothorax plus renflé en son milieu qu'à son extrémité antérieure, va diminuant vers son extrémité thoracique
Le thorax comprend les cinq somites normaux des copépodes, seuls les somites thoraciques 2, 3, 4 et 5 sont indépendants, et la taille de chacun d'eux va en diminuant peu à peu vers l'abdomen. La section d'un somite est circulaire, légèrement carénée sur la ligne médiane ventrale.
Les pattes thoraciques sont des appendices typiques de copépodes; elles montrent les parties classiques qui existent chez les espèces pélagiques: elles sont biramées et portent de longues soies natatoires. Leur nombre est d'une paire par somite thoracique; mais chez la femelle, la 5ème paire est moins développée que les précédentes et chez le mâle elle fait défaut. Les appendices thoraciques sont construits sur le même plan chez le mâle et chez la femelle. Elle est formée d'une pârtie basilaire, le protopodite qui supporte deux rames représentant l'exopodite et l'endopodite. Le protopodite est inséré sur la face ventrale du somite et présente deux segments; le premier articulé avec le somite est plus développé, plus long et plus épais que le second. En avant et en arrière du protopodite existent deux sillons qui semblent le diviser longitudinalement et prolonger en quelque sorte la bifurcation qui produit l'exopodite et l'endopodite. Cette partie basilaire présente une soie unique insérée sur le bord externe du second segment.
Les deux rames natatoires sont formées chacune de trois segments. Les trois segments de l'exopodite portent des soies plumeuses ou des épines ainsi distribuées: 1er segment avec 1 épine externe: 2ème segment avec 1 soie interne; 3ème segment avec 5 soies internes ou terminales et 1 épine externe; soit au total 2 épines externes et 6 soies internes. Les trois segments de l'endopodite ne portent que des soies au nombre de 7 ainsi réparties: 1er segment avec 1 soie interne; 2ème segment avec 1 soie interne; 3ème segment avec 5 soies internes ou terminales.
Cette répartition des soies et épines paraît assez constante pour tous les Monstrillides.
Les partie basilaires des pattes thoraciques d'un même somite sont réunies entre elles par un pont chitineux. Ce repli très fréquent chez les copépodes pélagiques, couple ainsi les deux pattes natatoires d'un même somite et sert à régulariser les mouvements de natation.
la cinquième patte thoracique (P5) de la femelle est beaucoup moins développée que les précédentes. La partie basilaire non segmentée comprend un exopodite formé d'une seule pièce et supportant 3 soies, et un endopodite réduit à un moignon sans aucune production sétigère.
Chez la femelle, l'abdomen comprend chez Haemocera danae 3 segments distincts, plus la furca (= rames caudales). Le 1er somite abdominal porte les orifices et les appendices génitaux; chez cette espèce deux segments ordinaires entre le segment génital et la furca; c'est là une des caractéristiques du genre Haematocera par rapport aux genres Thaumaleus et Monstrilla. Le segment génital est plus large et plus long que les segments suivants; sa longueur dépasse celle des deux segments suivants réunis; sa région postérieure est délimitée (chez certains exemplaires) par une légère constriction qui le fait ressembler à un somite double (cette forme est compréhensible, puisque l'on admet généralement que le premier segment abdominal est un segment complexe. Les orifices génitaux sont difficiles à distinguer et leur localisation n'est pas figuré dans les travaux à ce jour. On aperçoit sur la face ventrale du 1er somite de l'abdomen, sur le tiers antérieur une forte éminence chitineuse en arc de cercle supportant 2 fortes soies très longues qui se prolongent en arrière et atteignent environ trois fois la longueur de l'abdomen. La surface de ces soies est rugueuse, irrégulière; avant leur terminaison en pointe, elles présentent un renflement. Ce sont les soies destinées à supporter le sac ovigère, lorsque les oeufs ont été pondus. Chez H. danae l'insertion de ces soies sur l'éminence chitineuse basilaire est distincte (caractère du genre); ces soies peuvent être soudées à leur base sur une certaine étendue chez d'autres formes décrites (Bourne, Giesbrecht). Les deux conduits génitaux oviductaires viennent se terminer un peu en arrière des soies génitales. Ils s'accolent ventralement aux parois du corps et présentent chacun un petit orifice. Pas observé de pore de fécondation, sans en contester l'existence.
Les deux segments abdominaux qui suivent le génital sont d'égale dimension.
La furca (= caudal rami) présente sur chacune de ses divisions 3 soies divergentes régulièrement effilées et barbelées de filaments très fins diminuant progressivement de taille vers la pointe.
L'abdomen du mâle comprend 4 segments en outre de la furca, soit un de plus que chez la femelle. Le 1er segment abdominal porte comme chez la femelle un appendice génital qui comporte une partie basilaire et 2 appendices cylindriques divergents.
Avant la mue qui suit la libération de l'hôte, les spermatophores sont engagés par leur extrémité terminale dans la partie basilaire. Après la mue, les spermatophores s'engagent respectivement par leur extrémité dans les appendices droit et gauche et font saillie par les orifices terminaux. C'est dans cette situation qu'ils sont figurés (Pl. II, nos 4 et 5).
Les 3 segments abdominaux qui sont compris entre le génital et le furcal [qui n'est plus considéré comme un somite] sont sensiblement égaux en longueur, mais diminuent légèrement de largeur.
Les deux branches de la furca présentent, comme chez la femelle, de fortes soies divergentes et barbelées; au nombre de 4 sur chacune des branches furcales.
Organisation interne :
- La structure des téguments est très simple chez l'adulte capturé et libre, mais lorsqu'il il vient de sortir de l'hôte, la cuticule chitineuse est double; cela tient à ce qu'il existe une mue au début de la vie libre. Lors de l'éclosion, les deux enveloppes cuticulaires coexistent. Après la mue, les soies, masquée auparavant par l'enveloppe cuticulaire externe, apparaissent nettement avec leurs barbelures. L'épiderme de l'adulte est réduit à une couche extrêmement mince; à mesure que la vie libre s'avance, les cellules épidermiques finissent par disparaître et le céphalothorax après la ponte ne présente extérieurement que la cuticule (PL. 3, fig.3).
- Rudiment du tube digestif :
La bouche minuscule donne accès dans un tube étroit, revêtu intérieurement de chitine. Chez les individus du sexe mâle et femelle, à leur sortie, ce tube se dirige vers la face dorsale en s'inclinant légèrement vers l'arrière, pénètre à travers le système nerveux et se termine en cul-de-sac à peu près à égale distance de la face dorsale et ventrale. La structure de ce rudiment est très simple, il consiste en un épithélium revêtant et secrétant le tube chitineux interne. Il correspond à une invagination stomodéale ectodermique. Il se forme au début de l'ontogénèse, et l'on peut en retrouver des vestiges chez l'adulte, un amas de cellules embryonnaires qui reptrésentent les éléments endodermiques indifférenciés; cet amas étant accolé contre le cerveau, le stomodeum se terminant contre lui.
- Le système nerveux ne s'écarte pas de la structure qu'il offre d'ordinaire chez les copépodes, si l'état rudimentaire du pharynx ne venait modifier les rapports du cerveau et de la masse nerveuse sous-oesophagienne. La présence d'un tube stomodéal étroit, au lieu d'un pharynx ordinaire aboutissant à un estomac, disposition qui nécessite la séparation nette des masses nerveuses supra et sous-oesophagienne, amène une coalescence presque complète entre la partie dorsale et ventrale du système nerveux. Le cerveau est limité en avant par les trois yeux volumineux, contre lesquels il vient buter. En arrière, il se prolonge dans la cavité du céphalon, sans adhérer aux parois du corps. Le cordon ventral ganglionnaire s'étend dans toute la longueur du céphalothorax, il cesse avant l'abdomen. Les ganglions sont beaucoup plus nets chez le mâle que chez la femelle. Chez celle-ci, le système nerveux ventral est un cordon d'un calibre à peu près uniforme dans toute sa longueur. Chez le mâle, en arrière de la masse oesophagienne, la chaîne nerveuse présente plusieurs ganglions distincts et compris dans le céphalon. L'absence de ganglions céphalothoraciques chez la femelle est liée à la disparition des appendices de cette région. La présence de ces ganglions nettement accusés chez le mâle, malgré le manque d'appendices céphalothoraciques, ne peut s'expliquer que par l'existence dans cette région d'une musculature très puuissante.
Organe des sens :
- Les organes sont les soies et les yeux.
1 - Les soies tactiles des antennes antérieures (A1).
2 - Les soies olfactives, de forme pénicillée, également sur les antennes antérieures.
3 - Les yeux: Au nombre de trois, très volumineux. Ils occupent chez le mâle toute la région antérieure ou frontale du céphalothorax et en emplissent toute la largeur et toute l'épaisseur, tandis que chez la femelle, il reste un espace vide entre les parois du corps et les yeux.
Les organes visuels sont formés de trois coupes pigmentaires, dont chacune comprend un peu plus que la moitié d'une spère et disposées : 2 vers la face dorsale, 1 vers la face ventrale. Elles sont juxtaposées et réunies au centre par leur surface convexe. Le pigment est abondant, de couleur brun rougeâtre foncé.
L'intérieur de chaque coupe est occupé par des éléments clairs venant affleurer à la surface. Ces éléments sont très réfringents; sur les individus fixés ils se décomposent, montrant sur la face externe de la coupe des polygones assez réguliers, au nombre de 9, de forme sensiblement hexagonale (PL. I, fig.2b).
Musculature :
- La musculature est très développé chez le mâle et comprend: 1 - Les muscles généraux du céphalothorax, du thorax et de l'abdomen; 2 - La musculature des appendices, en y comprenant les muscles communs au tronc et à l'appendice. Les muscles sont tous striés.
- Les muscle généraux correspondent au céphalothorax, et forment trois groupes symétriques à direction longitudinale. Le premier est formé de 2 muscles dorsaux (M. d.) composés chacun de 2 faisceaux de fibres; le second par 2 muscles latéro-dorsaux, très voisins du groupe précédent, comprenant chacun 3 faisceaux; le troisième groupe, par 2 muscles ventraux, plus larges que les précédents et possèdent 5 faisceaux chacun..
Dans la région postérieure du céphalothorax, dont le diamètre est plus étroit, ces muscles sont serrés les uns contre les autres. Ils s'écartent davantage, s'étalent dans la partie antérieure du céphalon et vont se terminer sur les téguments dans la partie contiguë à la région oculaire.
Dans les segments thoraciques et abdominaux, il n'existe plus que 2 groupes de muscles longitudinaux qui vont en s'amincissant presque dans la furca où ils se terminent. L'un dorsal, est le prolongement des 2 groupes dorsaux et latéro-dorsaux du céphalothorax, l'autre est ventral. Ils arrivent à se fusionner dans les deux branches furcales.
Chez la femelle, la musculature du céphalothorax est extrêmement réduite. Elle n'existe que dans la partie correspondant au 1er somite thoracique et s'étend un peu en avant (fig. 1, 2a, 3). L'on y retrouve les muscles dorsaux et ventraux s'insérant en éventail sur les parois du corps et se continuant dans les différents somites du thorax et de l'abdomen avec la disposition notée chez le mâle.
2 - Musculature spéciale:
(a) - Des antennes antérieures (A1): Les muscles s'unissent sur la région antérieure céphalique, à droite et à gauche des yeux. Ils se partagent en 2 groupes principaux cheminant dans la cavité de l'appendice. Ils envoient des branches accessoires se fixant sur les différents segments.
(b) - Des Yeux: 2 muscles latéraux à direction légèrement descendante vers la face ventrale s'attachent d'une part sur les téguments, d'autre part sur les yeux latéraux.
(c) - Des pattes thoraciques: Les muscles moteurs des appendices locomoteurs comprennent deux sortes de muscles: les uns extrinsèques sont en grande partie situés dans le somite thoracique, les autres extrinsèques sont placés en totalité dans l'intérieur du membre (Fig. 1 à 5; fig.1 dans le texte).
- Muscles extrinsèques: Pour chaque patte thoracique, il existe un groupe musculaire formé de 5 faisceaux de fibres striées avec la même disposition pour les différents somites, dans les deux sexes. Chaque groupe s'insère en éventail sur les téguments dorsaux, traverse la cavité du corps en se dirigeant vers la partie ventrale du somite au point où s'articule le protopodite du membre thoracique. les 5 faisceaux, d'abord écartés et étalés, se rapprochent et se serrent les uns contre les autres pour pénétrer dans l'intérieur du membre.
- Muscles intrinsèques: Les muscles sont répartis par faisceaux parcourant plus ou moins obliquement la longueur des deux segments du protopodite (fig.1 dans le texte).Ces faisceaux sont , d'une part, ceux qui pénètrent du somite dans le protopodite et qui vont se jeter sur les parois, et d"-'autre part, des faisceaux obliques qui actionnent l'exopodite et l'endopodite. Deux faisceaux obliques, presque transversaux par rapport à l'axe de l'appendice, servent à imprimer les mouvements à l'exopodite. Il existe aussi 2 faisceaux plus courts et à trajet longitudinal servant à actionner les endopodites.
Système cavitaire, circulation :
Le système cavitaire se confond complètement avec le système circulatoire. Il n'existe aucun organe spécial pour la propulsion du sang; pas de vaisseau ou même de lacune endiguée par des parois, bien qu'il y ait un courant sanguin déterminé.
Les espaces interorganiques sont dépourvus de parois propres. Il n'y a pas trace d'endothélium, tant sur les parois du corps qui limitent la cavité du corps que sur les muscles qui la traversent.
Chez l'adulte, la circulation sanguine n'existe plus; il persiste quelques espaces sanguins où les éléments figurés disparaissent rapidement. Le sang ne se renouvelle pas, en effet puisque l'animal ne peut prendre aucune nourriture, mais a emporté quelques substances de réserve.
Substances de réserve :
Elles consistent en gouttelettes huileuses de couleur brun rougeâtre disséminées dans la cavité du corps et principalement le long des muscles; elles sont disposées parallèlement au système musculaire (fig. 1 à 5). Le céphalothorax des mâles en est abondamment pourvu, tandis que la même région chez la femelle n'en présente que dans la partie correspondant au 1er segment thoracique..
La quantité de substances de réserve ainsi représentée par les globules sphériques, huileux et colorés, diminue à mesure de l'éloignement de la mise en liberté du copépode; elles sont brûlées durant la période de locomotion active et rapide. Il est vraisemblable que ce dépôt d'aliments huileux est consommé directement par les muscles. Le tissu musculaire est celui qui disparaît le dernier dans cette vie éphémère; tous les organes sont frappés de dégénérescence; dans cette atrophie régressive, le système des muscles striés est encore respecté, et le monstrillide nage activement alors que les yeux ont complètement disparu.
Organes génitaux :
1- Chez la femelle:
(a)- Avant la ponte (Pl. II, fig. 1 et 2a), les ovaires, dont les produits sont mûrs au moment où la vie libre commence, remplissent toute la cavité céphalothoracique. Les oeufs sont verts (ou jaune brun) et forment deux masses allongées, symétriques, fusionnées en avant, où la masse ovarienne s'avance jusqu'à une petite distance du cerveau (fig. 2a, 2b). Puis les deux moitiés de l'ovaire s'étendent parallèlement en arrière sur toute la longueur du céphalothorax et en diminuant peu à peu d'épaisseur. Elles se continuent directement par les deux oviductes qui prolongent la glande génitale, traversent les différents somites du thorax et se terminent dans le 1er segment abdominal, en arrière de la plaque chitineuse portant les deux longues soies destinées à soutenir le sac ovigère.
(b) - Après la ponte, l'accouplement n'a pu être observée dans les bacs d'observation. Les oeufs sont agglutinés par une substance muqueuse sur les deux longues soies génitales. Ce mucus est produit dans la partie terminale des deux oviductes dont les parois épithéliales sont formés par des cellules secrétantes.
Lorsque les oeufs sont pondus, la cavité céphalothoracique se vide à peu près complètement. Il ne reste plus en avant que les yeux et le cerveau. Tout l'espace compris entre ces organes et le 1er somite thoracique est tapissé par la paroi mince épidermique. Cette paroi se décolle et se rétracte, vers le milieu du corps, quand les oeufs ont quitté leur situation primitive; seule la cuticule demeure en place (fig.3). L'épiderme rétracté dans l'axe du corps forme un tractus qui part du cerveau et des yeux et s'étend jusqu'au segment thoracique. On peut voir, avant dégénérescence avancée, le cordon nerveux ventral qui a suivi le mouvement de la couche épidermique. Mais le décollement n'a pas lieu dans la partie où le stomodeum s'insère sur la bouche; de sorte que le tractus axial est relié par le pharynx rudimentaire à la paroi ventrale du corps.
2 - Chez le mâle:
Les produits sexuels ont abandonné leur situation primitive dans le céphalothorax, au moment de la mise en liberté; ils sont contenus dans deux spermatophores. Au début de la vie libre et avant la mue, les 2 spermatophores sont contenus dans les canaux déférents droit et gauche. Ils occupent les derniers segments thoraciques (3è, 4è et 5è) et leur extrémité distale est engagée dans la partie basilaire des appendices génitaux situés sur la face ventrale du 1er segment de l'abdomen. Après la mue, les spermatophoress'engagent respecxtivement dans chacun des appendices du mâle et font saillie à leur extrémité (figs. 4 et 5).
Il existe une mue au début de la vie libre et pélagique. L'aspect du Monstrillide avant et après cette mue varie, quand aux appendices sétigères. La première enveloppe cuticulaire, l'externe qui doit tomber, engaîne la plus grande partie des soies antennaires, et, d'autre part, les soies des pattes thoraciques, ainsi que les grandes soies furcales, ne prennent leur aspect plumeux qu'après la chute de la cuticule externe. Celle-ci précède la maturité sexuelle complète. La figure 1, Pl. II, montre une femelle avant la mue, les figures 2a et 3 d'après des exemplaires qui ont mué. |
 Issued from : A. Malaquin in Arch. Zool. Exp. Gen., 1901, 3ème ser., IX. [Pl. III, figs. 10, 11, 12, 13, 14]. As Haemocera danae (= Monstrilla danae Malaquin, 1901 (non Claparède, 1863). 10, Salmacyna dysteri Huxley, infested by two different sexes of parasit's monstrillid. The first, anterior most, male (Pl. V, fig.35) (about 1 mm), the second, female (Pl. V, fig.34); 11, Salmacyna dysteri , in dorsal view, with three parasites (giving males) (Pl. IV, figs. 23, 32); 12, the same host infested by female in the ending development, dorsal view (asterisk indicates the way out of parasite; 13, S. dysteri dorsal view; 14, S. dysteri in lateral view with three paraites; 15, S. dysteri parasited by six parasites, the five first have approximatery the same age, the last introduced more recently or backward development. |
 I |
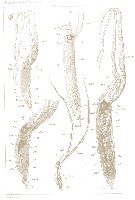 Issued from : A. Malaquin in Arch. Zool. Exp. Gen., 1901, 3ème ser., IX. [Pl. V, Figs.33 to 37]. As Haemocera danae (= Monstrilla danae Malaquin, 1901 (non Claparède, 1863). Embryo female extracted from vascular system from the Salmacyne: 33: famale body length 0.400 mm. 34: female body length 0.650 mm (Pl. III, fig.10). 35: embryo male, body length about 0.650 mm, sheath long 1 mm. 36: the same (different scale), showing very long tentacles antennular (an 2t) and blood lacunae (L.t, L); located in the host (Hae male in Pl.III, figs.10 and 11). 37: Male almost adult, length 1 mm (antennular base to curvature thoraco-abdominal), sheath length 1.450 mm. (corresponding fig.14, Pl. III, Hae 2. |
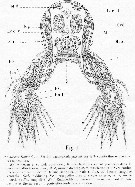 Issue de : A. Malaquin in Arch. Zool. Exp. Gen., 1901, 3ème ser., IX. [p.93, Figs.1]. Comme Haemocera danae (= Monstrilla danae Malaquin, 1901 (non Claparède, 1863). Section transversale passant par le 3ème somite thoracique avec ses appendices. |
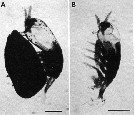 Issued from : M.J. Grygier & S. Ohtsuka in Zool. J. Lin. Soc., 2008, 152 [p.477, Fig.3]. Ovigerous females of Maemonstrilla gen. nov., south coast of Ishigaki Island, 1994, photomicrographs of preserved specimens. A, Maemonstrilla polka female (holotype), with large egg mass; B, Maemonstrilla turgida (A. Scott, 1909) comb. nov., with a few eggs attached to the anteriorly pointing ovigerous spines directed forward (subthoracic brooding). Scale bars = 0.5 mm. |
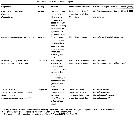 Issued from : D. Jeon, W. Lee & H.Y. Soh in J. Crustacean Biol., 2018, 38 (1). [p.62, Table 3]. Polychaete hosts of monstrilloid copepods. | | | | | | (1) Australomonstrillopsis Suarez-Morales & McKinnon, 2014 | |
| | Ref.: | Suarez-Morales & McKinnon, 2014 (p.315) | | Rem.: | The new genus is erected by Suarez-Morales & McKinnon (2014, p.315) to accomodate a male specimen with a remarkable combination of important genus level characters not present in any other genus of the Monstrilloida.
It has a 5-segmented geniculate A1 that resembles that of Monstrillopsis in its general structure and armature, particularly in the presence of an inner protuberance of the last segment and the structure of the apical elenents. Setal element 2 (sensu Huys & al., 2007) forms a distinctive sabre-like structure in males of Monstrillopsis (Suarez-Morales & al., 2006) and element 1 is relatively short (as in M. fosshageni, M. chathamensis, M. cahuitae). In the new genus element 2 is short, curved and only slightly longer than element 1. This character is not present in males of Monstrillopsis. Another unique character present is the peculiar cuticular processes of the cephalothorax, forming sac-like protuberances on the anteroventral surface but also dorsal folds.
An important apomorphy found in this genus is the absence of an inner seta on the 1st segment of the exopods of P1-P4. The absence of such a seta is shared only with Maemonstrilla (Grygier & Ohtsuka, 1008).
Type species: Australomonstrillopsis crassicauda.
Total 1 sp. | | | | (2) Caromiobenella Jeon, Lee & Soh, 2018 | |
| | Ref.: | Jeon & al., 2018 (p.47, Def.); Suarez-Morales & Castellanos-Osorio, 219 (p.118: Rem) | | Rem.: | A partir des mâles des deux nouvelles espèces de ce nouveau genre, certains caractères sont aussi présents chez plusieurs espèces du genre Monstrilla: M.helgolandica, M. serricornis, M. arctica, M. hamatapex, M. pygmaea, M. patagonica. Seulement deux de ces espèces, M. helgolandica, M. patagonica sont connues des deux sexes..
Les espèces listées connues seulement comme males, sont caractérisés par une antennule modifiée distalement. Huys & Boxshall, 1991 and Suerez-Morales, 2001 définissent : Type 1 ne montre aucune modification spécifique du segment distal. Dans le type 2, ce segmentdistal qui présente une bosse hyaline sur le bord proximal interne, et graduellement effilé et courbé vers le sommet. Dans le type 3, le segment distal montre sur sur le botrd interne des crêtes transverses dentelées. le type 4 est similaire au troisième, mais beaucoup moins bien développé (voir in Huys & Boxshall, 1991, fig.2.5.7 C).
Antennules du type 1 sont présentes chez beaucoup d'espèces de monstrilla et Cymbasoma.
Le type 2 est spécifisue des males de Monstrillopsis, et a souvent été considéré comme un caractère de diagnose du genre (Huys & Boxshall, 1991; Suarez-Morales & al., 2006).
Le type 3 est spécifique des mâles de Caromiobenella, qui avait antérieurement reconnu comme un petit groupe à l'intérieur des Monstrilla (Sars, 1921; Huys & Boxshall, 1991; Suarez-Morales & al., 2008); en dépit de la distribution mondiale des espèces introduites dans ce nouveau genre, allant de la Norvège, la Méditerranée, les Etats-Unis et Canada, l'Argentine, l'Indonésie, le japon et la Corée, la modification de l' antennule est très semilaire parmi toutes ces espèces. Outre une commune morphologie; par co de l'antennule, les mâles de toutes les espèces placées dans le nouveau genre (d'où les combinaisons nouvelles), elles partagent un bas, plutôt peu développé et parfois peu apparente papille orale, trouvée principalement sur la face ventrale antérieure du cephalothorax.(Sars, 1921; Davis & Green, 1974; McAlice, 1985; Suarez-Morales, 2000; Suarez-Morales & al., 2008),par contraste, les femelles de C. hamatapex de Corée et du Japon montrent une relative proéminente papille orale (Grygier & Ohtsuka, 1995; Chang, 2014). D'autres femelles, tels que C. helgolandica and C. patagonica ont également une papille orale proéminente située au milieu ou proche du milieu de la face ventrale du cephalothorax (Claus, 1863; Scott, 1909; Sars, 1921; Gallien, 1934; Sewell, 1949; Park, 1967; Ramirez, 1971; McAlice, 1985: Suarez-Morales & al., 2008). Ainsi les caractéristiques morphologiques de la papille orale dans le genre Caromiobenella apparaissent être sexuellement dimorphiques.
Grygier & Ohtsuka (1995) proposèrent 4 types de soies à l'armature basale des A1 females des monstrilloids (see in Suarez-Morales, 2011); le second segment des A1 porte typiquement 5 épines (2v 1-3, 2d 1,2) et une longue soie soyeuse, dorsale (IId). Le second segment des mâles porte aussi les mêmes éléments chez les deux espèces du nouveau genre Caromiobenella, mais l'épine 2d se distingue des autres épines 2v 1-3 et 2d 1: elle peut être plumose bisérialement, élongée, ou les dux. Une telle épine s'observe chez C. helgolandica (females in Park, 1967) et C. pygmaea (Suarez-Morales, 2000) comme dans les deux nouvelles espèces C. castorea et C. polluxea. Deux autres espèces, femelles de C. hamatapex (Grygier & Ohtsuka, 1995; Chang, 2014) et males de C. patagonica (Suarez-Morales & al., 2008) ont une épine (2d 2 plumose mais non élancée, et qui est presque de la même longueur que les autres éléments spineux du second segment. La femelle de C. patagonia d'Argentine (Ramirez, 1971; Suarez-Morales & al., 2008) montre une une épine élancée d'identité incertain.; une telle variation constitue un dimorphisme sexuel ou des différences spécifiques. Si l'on inclue la modification de l'épine 2d 2 comme un caractère générique de Caromiobenella, alors, l'épine élancée de la femelle de C. partagonica peut être interprétée comme 2d 2 et non 2d 1, comme proposée à l'origine.
L'élément setal modifié 2d 2, a été également reporté chez quelques mâles de Cymbasoma Thompson, 1888 (Suarez-Morales & McKinnon, 2016: C. longispinosum (Bourne, 1890), C. tropicum (Wolfenden, 1905), C. chelemense Suarez-Morales & Escamilla, 1997, C. rochai Suarez-Morales & Dias, 2001, C. ballatum (Scott, 1909), and C. bitumidum Suarez-Morales & McKinnon, 2016, mais qui ne montre pas toujours une épine allongée 1 sur le premier segment antennulaire, qui est seulement modérément développée chez Caromiobenella.
Une épine modifiée 2d 2 est rare dans le genre Monstrilla. Les femelles de deux espèces, M. inserta Scott, 1909 et M. brasiliensis Suarez-Morales & Dias, 2000, ont un élément setal allongé sur le second segment de l'antennule, mais celui-ci a été reconnu comme une épine 2v 3, et non 2d 2, compte-tenu de sa position parmi les autres épines (Scott, 1909; Suarez-Morales & Dias, 2000; Suarez-Morales, 2001)
Deux types de genitalia mâle ont été reconnu dans le nouveau genre, ceux avec une profonde encoche triangulaire sur le bord postérieur dista du conduit génital et ceux qui présentent une protrusion lisse médiale. C. castorea, C. helgolandica, C. pygmaea, C. patagonica sont du premier type, et C. polluxea, C. serricornis du second type.
L'appareil génital mâle chez C. arctica et C. hamatapex sont insuffisamment connus. Davis & Green (1974, p.59) décrivent ''une pair d'un petit processus épineux'' s'élevavnt de l'extrémité distale du conduit génital chez C. arctica et comparée avec celle de Monstrilla canadensis (= C. helgolandica). McMurrich (1917, p.48) note également '' l 'encoche sur l'orifice génital est flanquée de chaque côté par environ 3 courtes épines''. Les structures épineuses mentionnées dans ces études pourraient être des couvercles operculaires. Les extrémités distales de ces couvercles chez C. castorea, C. polluxea font souvent saillies en vue latérale et fendues en plusieurs fins brins près du sommet; Ces crevasses sommitales sont couvertes de nombreuses setules chez C. castorea.
La ressemblance générale parmi les espèces, du genitalia présentant un robuste conduit génital, de courts rabats, et souvent des volets operculaires protubérant, pourrait être considérée comme un autre caractère générique de Caromiobenella.
En terme du nombre de soies caudales, Caromiobenelle peut être divisé en 2 sous-groupes: C. castorea, C. arctica, C. hamatapex, C. patagonica ayant 6 soies sur chaque rame caudale et C. polluxea, C. helgolandica, C. serricornis, C. pygmaea ayant 5 soies. The caudal armement varie selon la longueur des soies et l'ornementation à l'intérieur de chacun des groupes. Les deux groupes d'espèces basés sur le nombre de soies caudales sont en contradiction avec ceux basés sur le genitalia mâle, ainsi aucune division du genre en sous-genre ne peut être envisagée dans l'état actuel..
Au moins certaines espèces de Caromiobenella ont 2 paires de grands pores en forme de cratère sur la surface antérieure dorsale du cephalothorax. Bien que non considéré comme significatif, cette structure et distribution est bien présente chez les mâles des deux espèces, aussi bien que chez les mâles des autres espèces mais non encore publiés. les femelles de C. hamatapex ont aussi des pores de cette sorte sur les sites correspondants du cephalothorax, et ceux-ci sont exprimés même plus clairement (voir in Chang, 2014). Deux rangs longitudinaux de 4 pores chacun, arrangés en paires au milieu sont aussi régulièrement présents sur la surface postérieure dorsale chez la femelle de C. hamatapex.
Le nouveau genre présente un ensemble unique de caractères, mais certaine ambiguité demeure dans le placement de toutes les espèces mentionnées dans le genre Caromiobenella y compris les deux nouvelles espèces.: Par exemple, le nombre des somites de l'urosome et des soies caudales correspondant à ceux des Monstrilla, tandis que les modifications de l'élément setal 2d 2, impliquant allongement et plumosité correspondent plus à quelques espèces de Cymbasoma.
L'analyse moléculaire fournit une alternative compensant les incertitudes et manques causés par l'analyse morphologique. L'analyse moléculaire réalisée par les auteurs montre fortement la séparation du genre Caromiobenella du genre Monstrilla, qui les distingue par deux différences à l'intérieur et entre-genre: 23.24 % intérieur du genre, 48.15 % entre les genres en ce qui concerne le gène mtCOI et 11.50 % dans le genre, et 22.07 % entre genre pour le gène 28S rRNA. La moyenne de divergence génétique entre les deux genres est de 42.18 % et 26.67 %, respectivement pour mtCOI et 28S rRNA.
Les divergences intra-générique chez Caromiobenella: 19.03%, 11.81 %) et Monstrilla 14.53 %, 8.41 %). |  Issued from : D. Jeon, W. Lee & H.Y. Soh inCaromiobenella and Monstrilla based on mtCOI and 28S rRNA genes (mtCOI/28S rRNA; in percentage, %; ND: no data) | | | | | (3) Cymbasoma Thompson, 1888 | |
| | Syn.: | Thaumaleus : Giesbrecht, 1892 (p.80, 578), non Kröyer, 1849; Malaquin, 1901 (p.106); van Breemen, 1908 a (p.201); Isaac, 1974 (p.128); 1975 (p.2) | | Ref.: | I.C. Thompson, 1888 b (p.154); Sars, 1921 (p.19); Sewell, 1949 (p.132); Wilson, 1932 a (p.395); Rose, 1933 a (p.346); Threlkeld, 1977 (p.227); Razouls,1982 (p.758); Grygier, 1994 (p.241); 1994 a (p.24); Chihara & Murano, 1997 (p.1002); Suarez-Morales & Riccardi, 1997 (p.105, key spp. M); Suarez-Morales, 1999 (p.71: key of M. in Mediterranean Sea); Suarez-Morales, 2000 a (p.209, key of M); Suarez-Morales, 2000 d (p.144, Rem.); Boxshall & Halsey, 2004 (p.837); Grygier & Ohtsuka, 2008 (p.460, Rem.); Vives & Shmeleva, 2010 (p.157, Rem., spp. key); Chang, C.Y, 2012 (p.131); Suarez-Morales & McKinnon, 2016 (p., 125: Key to the Australian species) | | Rem.: | type: Cymbasoma rigidum Thompson,1888. 41 espèces in Suarez-Morales, 2011 (p.4) + 25 espèces et 1 sp. in Suarez-Morales & McKinnon, 2016 (p.3). Total: 71 espèces + 1 indet.. | | Remarques sur les dimensions et le sex-ratio: | | For the body lengths from individuals measured from the anterior part of the head to the end of the caudal rami, the mean female size is 2.255 mm (n = 32; SD = 1.419), and the mean male size is 1.278 mm (n = 26; SD = 0.499). The size ratio (M:F) is 0.567. If one excludes the three species of which the lengths are exceptional (numbered 13, 16 and 30), the mean size females measure 1.962 mm (n = 26; SD = 0.8141), and a size ratio (M:F) 0.651. .
For the body lengths measured from the anterior part of the head to the end of the anal somite (without caudal rami), the mean female size is 2.012 mm (n = 24; SD = 1.431), and the mean male size is 1.350 mm (n = 9; SD = 0.420). The size ratio (M: F) is 0.671. | 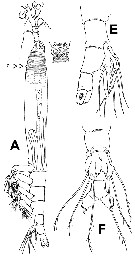 Issued from : E. Suarez-Morales & A.D. McKinnon in Zootaxa, 2016, 4102 [p.26, Fig. 13]. Cymbasoma annulocolle female: A, habitus (lateral view) with forehead showing pair of relatively large ocelli; E, urosome, showing P5 (lateral view); F, same (ventral view). o = oral papilla. |
 Issued from : E. Suarez-Morales & A.D. McKinnon in Zootaxa, 2016, 4102 [p.28, Fig. 15]. Cymbasoma annulocolle Male: A, habitus (dorsal view); C, cephalic area (dorsal view) showing large ocelli; D, urosome (dorsal view). |
 Issued from : E. Suarez-Morales & A.D. McKinnon in Zootaxa, 2016, 4102 [p.30, Fig. 17]. Cymbasoma annulocolle Male: A, urosome and genital complex (ventral view); B, same (dorsal view); C, cephalic area (lateral view) 0 = oral papilla. | | | | | Guanabaraenia Oliveira, 1945 | |
| | Ref.: | Oliveira, 1945 a (p.468); Razouls, 1982 (p.770) | | Rem.: | non Monstrillide | | | | | Ref.: | Malaquin, 1901 (p.108); van Breemen, 1908 a (p.202); Razouls, 1982 (p.770); Grygier, 1994 (p.240, Rem.); 1995 a (p.) | | Rem.: | Sars (1921, p.9) considère ce genre comme synonyme de Cymbasoma. Isaac (1974, 1975) ne reconnaît pas ce genre et ne retient pas les critères génériques in Sewell, 1949 (p.132). 1 espèce (non identifiable) | | | | (4) Maemonstrilla Grygier & Ohtsuka, 2008 | |
| | Ref.: | Grygier & Ohtsuka, 2008 (p.462, Key to the Rtukyu species); Ohtsuka & Nishida, 2017 (p.574, Rem.) | | Rem.: | Type: Maemonstrilla hyottoko. Avec 2 espèces-groupes: kyottoko groupe et turgida groupe. Total: 11 espèces. | | Remarques sur les dimensions et le sex-ratio: | | The mean female size is 1.685 mm (n = 13; SD = 0.352). It seems to note three groups: The little forms (species numbered 5 and 8) with the mean 0.627 mm (n = 3; SD = 0.172); the intermediate forms species numbered 1, 2, 3, 4, 6, 9, 10 with the mean 1.589 mm (n = 11; SD = 0.2738); and the large forms (species numbered 7 and 11) with the mean 2.140 mm (n = 4; SD = 0.2905). | 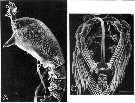 Issued from : M.J. Grygier & S. Ohtsuka in Zool. J. Lin. Soc., 2008, 152 [p.464, Fig.2 A, C]. Maemonstrilla hyottoko Female (from Sesoko Island), SEM : A, cephalothorax and metasome in lateral view (left legs removed) showing the conical oral papilla and the ovigerous spines directed forward; C, metasome and urosome (ventral view) showing ovigerous spines (small arrow), widely spaced P1-P4, and low, wide intercoxal sclerites (large arrow). | | | | | (5) Monstrilla Dana, 1849 | |
| | Syn.: | Monstrilla Dana,1849; Thaumatoëssa Kröyer, 1845 (= Thaumatoessia); Thaumaleus Kröyer, 1849 (in Damkaer & Damkaer, 1979, p.43); MonstrillopsisStrilloma : Isaac, 1974 a (p.134); 1975 (n°144/145, p.2, 6, 9); Razouls, 1982 (p.769) | | Ref.: | Claus, 1863 (p.164); Bourne, 1890 b (p.574); Giesbrecht, 1892 (p.80, 585); van Breemen, 1908 a (p.202); A. Scott, 1909 (p.234); Pesta, 1920 (p.635); Sars, 1921 (p.10); Wilson, 1932 a (p.393); Rose, 1933 a (p.339); Davis, 1949 a (p.246); Sewell, 1949 (p.131, 132, Rev.); Ramirez, 1971 b (p.379); Davis & Green, 1974 (p.62, Rem.); Isaac, 1974 (p.128); 1975 (n°144/145, p.2, 7, spp. key); 1975 b (p.163); Razouls, 1982 (p.761); Huys & Boxshall,1991 (p.154, 464); Grygier, 1994 (p.241, Rem.); 1995 (B.Z.N., 52 (3), p.245); B.Z.N., 1997, 54 (2) (p.131); Boxshall & Halsey, 2004 (p.837); Grygier & Ohtsuka, 2008 (p.460, Rem.); Vives & Shmeleva, 2010 (p.172, Rem., spp. key); Suarez-Morales & Castellanos-Osorio, 219 (p.120, Key of 5 females & males of the Mexican Caribbean). | | Rem.: | Type: Monstrilla viridis Dana, 1849. 52 espèces + 2 indeterminées (dont plusieurs douteuses). Nombre provisoire, les espèces du genre Monstrillopsis devant sans doute être incorporées à ce genre (Davis, 1949 a; Davis & Green, 1974).
Il est probable que de nombreuses espèces sont à redécrire et que des localisations géographiques soient douteuses. Depuis la création d'un nouveau genre Caomiobenella Jeon, Lee & Soh, 2018, with 2 nouvelles espèces et 6 nouvelles combinaisons et une espèce Monstrilla sp. Huys & Boxshall, le nombre des espèces de Monstrilla serait (probablement provisoirement) d'une cinquantaine. | | Remarques sur les dimensions et le sex-ratio: | | For the body lengths from individuals measured from the anterior part of the head to the end of the caudal rami, the mean female size is 2.789 mm (n = 44; SD = 1.0872), and the mean male size is 1.808 mm (n = 32; SD = 0.7938). The size ratio (M:F) is 0.6483.
For the body lengths measured from the anterior part of the head to the end of the anal somite (without caudal rami), the mean female size is 2.799 mm (n = 16; SD = 0.7070), and the mean male size is 1.783 mm (n = 4; SD = 1.0529). The size ratio (M: F) is 0.6370. | | | | (6) Monstrillopsis Sars, 1921 | |
| | Ref.: | Sars, 1921 (p.25, Rem.); Davis, 1949 a (p.246, Rem.); Sewell, 1949 (p.132, Rem.); Davis & Green, 1974 (p.62, Rem.); Isaac, 1974 (p.127); 1975 (n°144/145, p.2, spp. Key); Razouls, 1982 (p.768); Huys & Boxshall, 1991 (p.154,162, 165, 465); Grygier, 1994 (p.240, Rem.); Boxshall & Halsey, 2004 (p.837); Suarez-Morales & al., 2006 (p.101-105, tab.1, key females); Grygier & Ohtsuka, 2008 (p.460, Rem.); Vives & Shmeleva, 2010 (p.186, Rem., spp. key); Suarez-Morales & al., 2013 (p.619); Delaforge & al., 2017 (p.11: Rem.); Jeon & al., 2018 (p.62, Rem.: Haemocera Malaquin, 1901, synonym. | | Rem.: | type: Monstrilla dubia T. Scott,1904 . Les auteurs ne sont pas en accord sur la validité de ce genre malgré les arguments de Davis (1949 a) : ? Cf. Monstrilla. Total: 20 espèces (certaines probablement douteuses).
Diagnose d'après Sars (1921) in Rose (1933, p.352) :
- Corps différent dans les 2 sexes, allongé chez la femelle, court et trapu chez le mâle.
- Abdomen 3-segmented, le médian plus court
- Abdomen mâle 4-segmented.
- Caudal rami longues dans les deux sexes, chaque rame avec 4 soies égales (2 apicales, 1 interne et 1 externe)
- Oeil bien développé, surtout chez le mâle.
- A1 femelle 4-segments; mâle 5-segtments et géniculées.
- Tube oral très en avant.
- P5 femelle allongée, lobe externe avec 3 soies et 1 pointe apicale conique saillante, lobe interne conique et nu.
- Mâle avec appareil copulateur. | | Remarques sur les dimensions et le sex-ratio: | | For the body lengths from individuals measured from the anterior part of the head to the end of the caudal rami, the mean female size is 1.984 mm (n = 5; SD = 1.123), and the mean male size is 0.870 mm (n = 3; SD = 0.3205). The size ratio (M:F) is 0.4385.
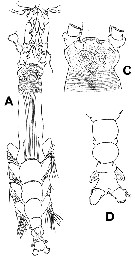
For the body lengths measured from the anterior part of the head to the end of the anal somite (without caudal rami), the mean female size is 2.325 mm (n = 8; SD = 0.823), and the mean male size is 0.940 mm (n = 7; SD = 0.5377). The size ratio (M: F) is 0.4043. | 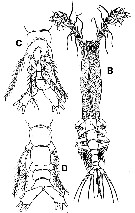 Issued from : A. Delaforge, E. Suarez-Morales, W. Walkusz, K. Campbell & C.J. Mundy in ZooKeys, 2017, 709. [p.6, Fig.2B, C, D]. Monstrillopsis planifronsFemale: G, habitus (dorsal view); C, urosome, ventral view, showing P5, (ovigerous spines not shown, only its insertion area); D, urosome, dorsal view. |
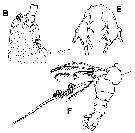 Issued from : A. Delaforge, E. Suarez-Morales, W. Walkusz, K. Campbell & C.J. Mundy in ZooKeys, 2017, 709. [p.67 Fig.3, B, E, F]. Monstrillopsis planifronsFemale: B, cephalic area showing forehead and perioral ornamentation, lateral view; E, P5, ventral view, showing small lobe-like processes on inner margin of exopodal (outer) lobes (arrowed); F, urosome, lateral view, showing P5 and ovigerous spines (with some eggs).
| | | | | | Ref.: | Isaac, 1974 a (p.134); 1975 (n°144/145, p.2, 6, 9); Razouls, 1982 (p.769); Huys & Boxshall, 1991 (p.154, Rem.); Boxshall & Halsey, 2004 (p.837) | | Rem.: | Le maintien de ce genre est discutable compte tenu de la qualité des illustrations. Type : Strilloma longa Isaac,1974. Suarez-Morales & Gasca (2004, p.292) confirment l'invalidité de ce genre. | | | | | Syn.: | Thaumatoëssa Kröyer, 1842-45; non Thaumaleus : Giesbrecht, 1892 (p.578) | | Ref.: | Malaquin, 1901 (p.85, 108); A. Scott, 1909 (p.239); Pesta, 1920 (p.632); Isaac, 1974 (p.128); 1975 (n°144/145, p.2, 3, 8, clé spp.); Threlkeld, 1977 (p.227); Razouls, 1982 (p.754); Huys & Boxshall, 1991 (p.154); Gryier, 1994 (p.235 & suiv., Rem.); 1995 (B.Z.N., 52 (3) (p.245); B.Z.N., 1997, 54, (2) (p.131) | | Rem.: | Type: Thaumaleus typicus Kröyer, 1849. Cf. Cymbasoma et Monstrilla | | | | Thaumatoessa Kröyer in Gaimard, 1842-1845 ? | |
| | Syn.: | Thaumaleus Kröyer,1849; Monstrilla Dana,1849 | | Ref.: | Grygier,1994 (p.241, Rem.) | | Rem.: | Malgré la règle de priorité, Grygier (1994) propose le maintien de Monstrilla sur Thaumatoessa et sur Thaumaleus (celui-ci étant considéré comme établi postérieurement) | | | | (0) Thaumatohessia Giard, 1900 (? Monstrillidae ) | |
| | Ref.: | Giard, 1900 (p.396); Isaac, 1975 (n°144/145, p.2); Razouls, 1982 (p.769); Huys & Boxshall, 1991 (p.154, Rem.) | | Rem.: | Total: 1 sp.
Ce genre créé pour comprendre une espèce tout à fait originale (Thaumatohessia armoricana (Hesse,1868) ne correspond pas à la diagnose de la famille, mais appartenant peut-être à une forme néoténique d'une espèce de l'un des genres précédents. Cette forme atypique qui présente des pièces buccales rudimentaires n'a jamais été retrouvée à Brest (parmi des corallines: Griffithsia corallina) | | | | | | Historique :
Parmi les copépodes pélagiques les Monstrillides constituent un cas particulier en raison des particularités de leur cycle biologique méroplanctonique et comme mode de parasitisme de type protélien. Numériquement, ils sont faiblement représentés dans les pêches qui sont généralement non adaptées à leur recherche. ils se distinguent aisément des autres copépodes par leur grande taille et leur morphologie.
Depuis le travail de Malaquin (1901) sur la biologie des Monstrillides qui comprend une première révision du groupe, nous ne disposons pas de nouvelles études d'ensemble les concernant à l'exception de nombreuses descriptions d'espèces nouvelles.
Une certaine confusion existe dans les synonymies par suite des quelques révisions envisagées: Van Breemen (1908 a), Sars (1921), Sars (1921), Wilson (1932 a), Sewell (1949), Davis (1949).
Pour Malaquin, la famille des Monstrillides comprend les deux genres revus par Giesbrecht (1892), plus un troisième créé par cet auteur en 1896, dont les caractères taxinomiques sont les suivants:
G1: Thaumaleus Kröyer,1849
Syn.: Monstrilla : Claparède, 1863; Möbius, 1884; Bourne, 1890; Cymbasoma : Thompson, 1888.
Ur : (F) : 2 Sgts; (M) : 3
F : (F) : 3 soies; (M) : 3 ou 4
A1 : (F) : 3 ou 4 Sgts; (M) : 5
Bouche en avant du céphalothorax.
G2: Monstrilla Dana,1848
Syn.: Cymbasoma : Thompson,1887
Ur : (F) : 4 Sgts; (M) : 4
F : (F & M ): 5 ou 6 soies
A1 : (F) : 4 Sgts; (M) : 5
Bouche au milieu du céphalothorax
G3: Haemocera Malaquin,1896
Syn.: Monstrilla : Claparède, 1863; Bourne, 1890; Thompson, 1893
Ur: (F) : 3 Sgts; (M) : 4
F: (F) : 3 ou 4 soies; (M) : 4
A1: (F) : 4 Sgts; (M) : 5
Bouche en avant du céphalothorax.
En 1921, Sars divise le sous-ordre des Monstrillides en deux sections bien définies comprenant chacune une seule famille:
Section 1: Monstrilloida cyclopimorpha avec la famille des Thaumatopsyllidae.
G: Thaumatopsyllus avec l'espèce type Thaumatopsyllus paradoxus Sars,1913.
Les copépodes qui appartiennent à cette famille sont aisément identifiables par la forme de leur corps de type cyclopoïde, la présence de trois paires de pattes thoraciques bien développées, l'articulation du corps entre les segments thoraciques 3 et 4, le segment anal très allongé.
Section 2: Monstrilloida genuina avec la famille des Monstrillidae
Cette famille comprend les deux genres définis antérieurement: Monstrilla Dana,1848 qui serait synonyme de Thaumaleus (Kröyer) non Giesbrecht. Le genre Thaumaleus utilisé par Giesbrect (1892) serait synonyme de Cymbasoma Thompson (1888) auquel il faudrait rallier le genre Haemocera créé par Malaquin (1896). Le critère principal de Sars repose sur le nombre de soies furcales chez la femelle. Sars crée en plus le genre Monstrillopsis afin d'y inclure l'espèce décrite par Scott (1904): Monstrilla dubia .
Les caractères de ces trois genres sont les suivants:
G1: Monstrilla Dana,1848
Ur: (F) : 3 Sgts; (M) : 4
F: (F) : 5 ou 6 soies; (M) : 4 ou 5 soies
Bouche généralement loin du front
P5 à 2 ou 3 soies
G2: Cymbasoma Thompson,1888
Ur: (F) : 2 Sgts; (M) : 3
F: (F) : 3 soies; (M) : 4 (parfois 3 soies ?)
A1: (F) : 4 Sgts; (M) : 5
Bouche plus près du front
P5 (F) à 2 lobes
G3: Monstrillopsis Sars,1921
Ur: (F) : 3 Sgts; (M) : 4
F: (F & M) : 4 soies
A1: (F) : 4 Sgts; (M) : 5
Bouche près du front
P5 bilobé (F); absent chez le mâle
G4: Thaumaleus Kröyer,1849
Ur: (F) : 2 Sgts, (M) : 3
F: linéaire, (F) : 5 soies
Bouche éloignée du bord antérieur de la tête
P4 femelle aussi longues que les autres paires de pattes.
Dans la "Faune de France", Rose (1933 a) reprend la classification de Sars. Cet auteur décrit sommairement neuf espèces du genre Monstrilla , neuf espèces du genre Cymbasoma et l'unique espèce du genre Monstrillopsis .
Monstrilla anglica Lubbock, 1857; M clavata Sars, 1921; M. gracilicauda Giesbrecht, 1892; M. grandis Giesbrecht, 1891; M. helgolandica Claus, 1863; M. longicornis Thompson, 1890; M. longiremis Giesbrecht, 1892; M. leucopis Sars, 1921; M. serricornis Sars, 1921.
Cymbasoma filogranarum (Malaquin, 1896) ; C. longispinosum (Bourne, 1890); C. malaquini (Caullery & Mesnil, 1914); C. reticulatum (Giesbrecht, 1892); C rigidum Thompson, 1888; C. roscovita (Malaquin, 1901); C. rostrata (T. Scott, 1904); C. thompsoni (Giesbrecht, 1892); C. zetlandica (T. Scott, 1904).
Monstrillopsis dubia (T. Scott, 1904).
En 1949, deux révisions des monstrillides sont réalisées séparément par Sewell et Davis. Ces deux auteurs n'admettent pas les genres définis par Sars, mais divergent dans leur conclusion. Les sections crées par Sars sont maintenues ainsi que le genre Thesiopsyllus de Wilson (1932 a); Sewell ajoute à la section des Cyclopimorphes un nouveau genre: Orientopsyllus .
La famille des Monstrillidae comprendrait les trois genres de Sars, mais aussi le maintien du genre Haemocera de Malaquin (non retenu par Rose qui considère H. danae comme synonyme de Cymbasoma rigidum ) et éventuellement le genre Thaumaleus de Kröyer (1849) dont le type serait T. typicus. Al Kholy (1963) étudie quelques espèces de Monstrillides de la Mer Rouge et décrit deux espèces nouvelles et une variété. Cet auteur expose brièvement les critères de la classification de Sewell qui sont résumés dans le tableau ci-après.
Le nombre des segments de l'urosome et le nombre des soies furcales permettent de séparer les genres Cymbasoma et Monstrilla . Les autres caractères n'autorisent pas la création d' autres genres. La famille des Monstrillidae ne comprend alors que deux genres: Monstrilla et Cymbasoma (Syn.: Monstrillopsis Sars et Haemocera Malaquin)
|
Monstrilla |
Monstrillopsis |
Haemocera |
Cymbasoma |
Urs: Sgts Femelle
Mâle |
3 ou 4
4 |
3
4 |
3
4 |
2
3 |
F: Soies Femelle
Mâle |
5 ou 6
4 ou 6 |
4
4 |
3 ou 4
3 ou 4 |
3 ou 4
3 ou 4
|
Bouche |
au milieu |
en avant |
en avant |
en avant |
A1 : Sgts Femelle
Mâle |
4 ou 5 (pls 2)
5 |
4
5 |
4
5 |
3 ou 4
5 |
P5 Mâle |
2 soies |
0 |
0 |
0 |
Yeux |
peu développés |
développés |
développés |
développés |
Davis fait paraître en 1949, à propos de la description de deux espèces nouvelles, une révision des Monstrillides accompagnée d'une clé basée sur les descriptions des divers auteurs. La séparation des genres d'après le nombre des segments de l'urosome ne constituerait pas un bon critère, certaines espèces présentant une tendance à la fusion des segments. Il suggère que toutes les espèces pourraient n'appartenir qu'à un seul genre: Monstrilla . Cet auteur propose provisoirement de classer les espèces dans les deux genres: Monstrilla (Syn.: Monstrillopsis ) et Thaumaleus (Syn.: Cymbasoma ).
Les espèces connues se répartissent alors de la façon suivante:
G.1: Monstrilla
M. anglica Lubbock, 1857; M. clavata Sars, 1921; M. canadensis McMurrich, 1917; M. conjunctiva Giesbrecht, 1902; M. cymbula A. Scott, 1909; M. dakinensis Davis, 1949; M. dubia T. Scott, 1904; M. floridana Davis, 1949; M. gracilicauda Giesbrecht, 1892; M. grandis Giesbrecht, 1891; M. helgolandica Claus, 1863; M. inserta A. Scott, 1909; M. leucopis Sars, 1921; M. longicornis Thompson, 1890; M. longipes A. Scott, 1909; M. longiremis Giesbrecht, 1892; M. mixta T. Scott, 1914; M. nicholsii Davis, 1949; M. orcula A. Scott, 1909; M. ostroumowi Karavaev, 1894; M. reticulata Davis, 1949; M. rugosa Davis, 1947; M. serricornis Sars, 1921; M. turgida A. Scott, 1909; M. wandelii Stephensen, 1913.
G.2: Thaumaleus
T. bullatus A. Scott, 1909; T. danae (Claparède, 1863); T. gigas A. Scott, 1909); T. gracile (Gurney, 1927); T. longispinosus (Bourne, 1890); T. quadridens (Davis, 1947); T. rigidum (Thompson, 1888); T. thompsoni Giesbrecht, 1892.
Remarques: Monstrilla viridis Dana,1849 de la mer de Sulu est omis en raison de sa description insuffisante. La description de quatre espèces par Davis (1947 et 1949 a): Monstrilla floridana , M. reticulata , M. rugosa et Cymbasoma quadridens incite l'auteur à considérer les deux genres Monstrilla et Monstrillopsis comme synonymes, de même que Thaumaleus et Cymbasoma , qu'il confirme en 1974.
Le genre Haemocera semble devoir être maintenu du fait de la synonymie discutable entre Monstrilla danae Claparède, 1863 et Haemocera danae Malaquin, 1901 ( in Sewell, 1949, remarque: p.145), bien que Grygier (1995 a, p.62) les considèrent comme synonymes.
La définition de ces différents genres serait la suivante:
|
Monstrilla |
Haemocera |
Cymbasoma
|
Thaumaleus |
Ur : Sgts Femelle
Mâle |
3 ou 4
4 |
3
4 |
2
3 |
2
3 |
F (soies): Femelle
Mâle |
4 à 6
4 à 6 |
3
4 |
large, 3
" , 4 |
étroite , 3
" , 4 |
Grygier (1994) réetudie l'espèce type Thaumatoessa typica illustré antérieurement ( in Atlas de Zoologie de Gaimard, 1842-1845 ?) par Kröyer et redécrit par cet auteur comme Thaumaleus typicus en 1849 ( in Damkaer & Damkaer, 1979) à partir d'un stade juvénile 5 femelle trouvé à l'entrée de Trondheimsfjorden (Norvège). Malgré l'antériorité du genre Thaumatoessa le genre Thaumaleus devrait être maintenu (Bulletin of Zoological Nomenclature, 52 (3), p.245). Cependant T. typica peut être un synonyme senior de Monstrilla longicornis Thompson,1890 et de Monstrilla clavata Sars,1921. Le genre Monstrilla , étant défini par l'espèce type Monstrilla viridis Dana, 1849 (non 1848), type de la famille des Monstrillidae (Grygier, 1995, p.247) est devenu d'usage courant.. Par ailleurs de nombreuses espèces ont été attibuées au genre Thaumaleus bien qu' identifiables au genre Cymbasoma avec pour espèce type Cymbasoma rigidum Thompson,1888
En 1974 Isaac crée le genre Strilloma avec pour espèce type Strilloma longa trouvé en Floride (Dry Tortugas), et repris dans les fiches d'identification du plancton de la CIEM (1975, n°144/145, p.2, 6, 9), mais contesté par Huys & Boxshall, 1991 (p.154, Rem .). L'auteur y inclus Strilloma lata (Desai & Bal,1963 comme Monstrilla lata ) de l'Océan Indien (Bombay) et de l'est de l'Ecosse (Firth of Forth). Le maintien de ce genre est discutable compte tenu de la qualité des illustrations.
Une contribution importante à la connaissance de nombreuses nouvelles espèces (12) est due à Suarez-Morales et coll. au cours de cette dernière période (1992-2004).
Ce court historique des diverses révisions de la famille des Monstrillidae et le recensement des espèces qu'il m'a été possible d'établir à partir des publications dont je dispose actuellement permet de tirer les conclusions suivantes:
De nombreuse espèces insuffisamment décrites nécessitent de nouvelles observations dans les localités types afin de permettre une clarification des synonymies.
L' élevage s'avère nécessaire si l'on suit l'opinion de Malaquin sur les répercussions de la dégénérescese de ces organismes sur les critères utilisés pour leur classification.
La spécificité parasitaire, par un examen et l'élevage de Polychètes et de Gastéropodes, serait un complément utile.
Le consensus actuel semble ne considérer que deux genres dans la famille des Monstrillidae: Cymbasoma et Monstrilla , plus éventuellement le cas atypique de Thaumatohessia Giard,1900.
Diverses identifications, sans commentaires, dans les listes faunistiques sont discutables. Dans ces conditions la répartition géographique des espèces demeure très incertaine.
Les travaux approfondis de Suarez-Morales ces dernières années et en cours devraient clarifier l'ensemble de cet ordre. | | | | | | | |
|
|
 Toute utilisation de ce site pour une publication sera mentionnée avec la référence suivante : Toute utilisation de ce site pour une publication sera mentionnée avec la référence suivante :
Razouls C., Desreumaux N., Kouwenberg J. et de Bovée F., 2005-2025. - Biodiversité des Copépodes planctoniques marins (morphologie, répartition géographique et données biologiques). Sorbonne Université, CNRS. Disponible sur http://copepodes.obs-banyuls.fr [Accédé le 02 octobre 2025] © copyright 2005-2025 Sorbonne Université, CNRS
|
|
 |
 |