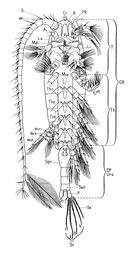
Introduction | Morphologie générale | Morphologie des diverses parties du corps et des appendices | Dimensions | Formes | Principales modifications structurelles | Les antennules | Les antennes |
Le cadre buccal : Labrum et labium | Les Mandibules | Les Maxillules ou premières maxilles | Les Maxilles (Maxilla) ou secondes maxilles | Les Maxillipèdes | Les pattes natatoires | Variation du nombre des segments corporels | Nomenclature des parties du corps et Métamérie | Structures et organes tégumentaires | Organes visuels |
Variations de la morphologie | Sex-ratio | Gynandromorphisme et intersexualité | Accouplement | Parthénogénèse | Caractéristique de la ponte |
Les formes larvaires | La durée du développement | La croissance | Régénération |
Anomalies | Classification et Phylogénie | Références | Photothèque
 Les Mandibules (Md) : Les Mandibules (Md) :
Chez les Copépodes à bouches gnathosthomes, l'appendice est de type biramé à exopodite et endopodite (fig. G3, C). G3, C).
La précoxa est une expansion chitineuse dentée à son extrémité distale: le processus molaire. Ce dernier, chez certains Harpacticoïdes, peut être interprété (Lang, 1965) comme présentant une <<pars molaris>> distincte du bord tranchant dû à une <<pars incisiva>> et à une <<lacinia mobilis>> (lame mobile caractéristique des Crustacés supérieurs).
Perpendiculairement à la lame masticatrice dans le plan de la bouche, on observe une coxa réduite et un basis portant latéralement un exopodite plurisegmenté et, à son extrémité distale, un endopodite à segments moins nombreux.
1 - Chez les Calanoida, l'appendice est le moins modifié (fig. G3, C, a), mais la tendance évolutive montre que l'exopodite tend à disparaître avant l'endopodite. Ce dernier ainsi que le basis peuvent disparaître à leur tour comme on le constate chez les Harpacticoïdes et les Cyclopoïdes gnathostomes. G3, C, a), mais la tendance évolutive montre que l'exopodite tend à disparaître avant l'endopodite. Ce dernier ainsi que le basis peuvent disparaître à leur tour comme on le constate chez les Harpacticoïdes et les Cyclopoïdes gnathostomes.
Le coxa porte une expansion chitineuse: la gnathobase, dentée à son extrémité distale (pars molaris) qui obstrue partiellement la bouche (Nival et Nival, 1978). Le coxa est réduit, son axe perpendiculaire à la lame masticatrice. Le basis porte un exopodite à 5 segments et un endopodite à 2 segments (ou peut-être respectivement 6 et 3 d'après Vaupel Klein, 1985). Huys et Boxshall (1991) considèrent que la segmentation ancestrale est retenue chez Pleuromamma xiphias.
Les mâles de plusieurs familles de Calanoïdes présentent à l'état adulte une atrophie plus ou moins marquée des mandibules, notamment de la lame masticatrice (Mazza, 1966). Celle-ci est totalement atrophiée chez Eucalanus elongatus, réduite et sans expansion dentiforme chez Gaetanus kruppi. Mazza (1967) souligne que les pièces buccales sont identiques dans les deux sexes au stade juvénile 5. La réduction des appendices buccaux n'atteint pas le même degré dans toutes les familles et porte soit sur les parties préhensiles, soit sur les parties masticatrices, soit dans les cas extrêmes sur les deux à la fois. Ceci suggère une nutrition réduite chez les mâles et par conséquent une durée de vie plus courte chez ceux-ci. Les sex-ratio observés pour les stades adultes en serait la résultante.
 La mandibule de type gnathostome peut présenter des variations selon le mode de nutrition dominant, lié à la nature des particules environnantes. Les herbivores "stricts", comme Calanus finmarchicus, montrent une lame masticatrice avec une partie distale à multiples dents fortes et courtes, subégales. Dans d'autres genres cette lame comporte deux parties, avec des formes de dents distinctes, traduisant une évolution vers un type de régime omnivore, tandis que chez d'autres le régime est plus nettement carnivore (Anraku et Omori,1963; Omori et Ikeda, 1984; Schnack, 1989). (fig. La mandibule de type gnathostome peut présenter des variations selon le mode de nutrition dominant, lié à la nature des particules environnantes. Les herbivores "stricts", comme Calanus finmarchicus, montrent une lame masticatrice avec une partie distale à multiples dents fortes et courtes, subégales. Dans d'autres genres cette lame comporte deux parties, avec des formes de dents distinctes, traduisant une évolution vers un type de régime omnivore, tandis que chez d'autres le régime est plus nettement carnivore (Anraku et Omori,1963; Omori et Ikeda, 1984; Schnack, 1989). (fig. G7). G7).
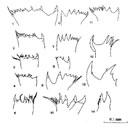
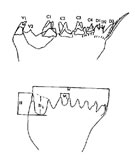
Itoh (1970) établit un algorithme qui décrit la structure du bord de la pars incisiva à partir du nombre de dents, leur espacement et leur hauteur. L'indice obtenu (Ie ou"Edge Index") varie de 100 à 3000.
De l'examen des nourritures consommées il établit trois groupes: les espèces dont l'indice est inférieur à 500 correspondent aux herbivores, celles dont l'indice est compris entre 500 et 900 sont des omnivores et celles dont l'indice est supérieur à 900 sont des carnivores (cf. tableau in Lapernat et Razouls, 2001) (Figs. G8, G8, G9, G9, G10). Cependant un examen de la plaque triturante, souvent complexe, montre que l'indice de Itoh ne peut rendre qu'imparfaitement le mode de régime alimentaire, notamment chez les formes omnivores, le plus souvent opportunistes. G10). Cependant un examen de la plaque triturante, souvent complexe, montre que l'indice de Itoh ne peut rendre qu'imparfaitement le mode de régime alimentaire, notamment chez les formes omnivores, le plus souvent opportunistes.
 Les nombreux travaux expérimentaux concernant la nutrition des copépodes pélagiques, principalement chez les calanoïdes, plus rarement dans d'autres ordres (Oithona, Corycaeus et Oncaea) révèlent que le régime alimentaire dépend de la concentration des proies présentes et de leurs dimensions (voir litt in Bonnet et al., 2004) Les nombreux travaux expérimentaux concernant la nutrition des copépodes pélagiques, principalement chez les calanoïdes, plus rarement dans d'autres ordres (Oithona, Corycaeus et Oncaea) révèlent que le régime alimentaire dépend de la concentration des proies présentes et de leurs dimensions (voir litt in Bonnet et al., 2004)
Le nombre et la forme des dents varient dans un même genre comme Calanus en fonction de la latitude (Vyshkvartzeva, 1975) (Fig. G11). Ces dents sont en relation avec la nature des algues consommées et, par conséquent, indirectement avec la température. G11). Ces dents sont en relation avec la nature des algues consommées et, par conséquent, indirectement avec la température.
La présence de couronne de silice sur les dents est une adaptation indispensable au broyage des frustules des Diatomées et le taux de silice dans le milieu peut constituer un facteur affectant la structure mandibulaire (Miller et al., 1980).
Dans la famille des Heterorahabdidae (Calanoida) Heptner (1972) montre qu'il existe une évolution des espèces sur la base de la structure des appendices buccaux liée au type de régime alimentaire, qui évolue du mode filtreur (Disseta) au mode carnivore suceur (Heterorhabdus) en passant par des formes euryphages (Heterostylites). Chez certaines formes, l'extrémité distale de la lame masticatrice montre ventrale ment une dent particulière, présentant un canal muni d'un pore subterminal et d'une ouverture basale ajustée à un pore cuticulaire d'une glande labrale située sous la face postérieure du labrum. On suppose qu'un anesthésique ou poison pourrait ainsi être injecté à la proie (Nishida et Ohtsuka, 1996).
2 - Chez les Harpacticoida, on observe une réduction de l'exopodite qui a tendance à disparaître avant l'endopodite lui-même réduit, remplacé par des soies sur le basis. Le processus molaire bien développé chez les formes benthiques avec une pars molaris à fortes dents, peut être réduite chez une forme pélagique comme Microsetella, mais encore puissante chez Volmannia.
C'est dans le groupe des Cyclopoïdes (au sens large) que la diversité des structures est la plus importante et a donné lieu à controverses jusqu'à la synthèse de Kabata (1979) adoptée dans ses grandes lignes par la plupart des spécialistes des copépodes libres ou parasites.
Antérieurement, Sars (1918) avait bien vu la nécessité d'établir des groupements (ou Sections) qui sont définis en réutilisant la terminologie de Thorell.
3 - Chez les Cyclopoida libres, l'exopodite et l'endopodite sont réduits, insérés sur un basis large, le processus molaire est bien développé avec de fortes dents (d'où l'ancienne section de Sars, 1913 (1918) p.3, des Cyclopoida gnathostoma) comme chez les Cyclopina, et moins nombreuses chez les Oithonidae à dents plus aigües, suggérant un régime plus carnivore qu'herbivore.
4- Les Poecilostomatoida libres ou commensaux ont des mandibules non segmentées très discrètes, avec un exopodite très réduit. Les parties distales de l'appendice sont munies de courtes soies (fig. G3, C, b1). G3, C, b1).
L'absence apparente d'une paire d'appendices buccaux fut attribuée par Sars à la disparition de la mandibule, mais il a été démontré par la suite (Gurney, 1933; Bocquet et Stock, 1963) qu'il s'agit de la maxillule.
Ces appendices ne sont à l'évidence adaptés ni à la mastication, ni à la succion, mais vraissemblablement, comme le suggère Sars (1918), au léchage de fines particules organiques réparties sur la surface de divers organismes. Ceci n'est toutefois pas confirmé dans le cas d'Oncaea (Turner, 1986). Dans les rares cas étudiés l'examen des contenus digestifs ne montre pas fondamentalement de différences avec celui des Calanoïdes.
La tendance parasitaire ou nécrophage du groupe est certaine, mais l'hôte n'est pas toujours bien défini du fait de la mobilité des espèces libres. Certaines à partir de ce mode de vie épibenthique, sont venues occuper des niches écologiques vacantes dans le plancton comme par exemple les familles des Oncaeidae et Corycaeidae, et les Sapphirinidae, chez lesquels la tendance au commensalisme est démontrée par leur association avec les Tuniciers pélagiques.
La forme typique en faucille indiquée par Kabata (1979, p.28) montre chez les Clausidiidae, Corycaeidae, Oncaeidae, Erebonasteridae, deux petites lames séparés à l'extrémité distale de la gnathobase. Chez Lubbockia, la forme en faucille est maintenue. Chez Paralubbockia, la mandibule montre un dimorphisme sexuel suggérant une réduction de la nutrition chez le mâle (Huys et Boxshall, 1991, p.288). Chez Paralubbockia longipedia, la mandibule de la femelle est plus forte que celle du mâle.
Les Cyclopoïdes siphonostomes, par leur bouche tubulaire, confirment des comportements semi-parasites et parasitaires. Les mandibules sont modifiées en fonction des variations du développement du labrum et labium ou elles prennent généralement un aspect styliforme (fig. G3, C, b2). G3, C, b2).
5 - Chez les Siphonostomatoida libres, mais sans doute commensaux d'invertébrés planctoniques ou de poissons (Ratania, Pontoeciella et Hyalopontius), la gnathobase est longue, stylisme, finement denticulée à l'extrémité distale, sans palpe chez les formes pélagiques. Un palpe rudimentaire à deux segments et deux soies à l'apex s'observe encore chez une forme qui a conservé ce caractère plésiomorphe (Asterocheres reginae)
6 - Les Monstilloida constituent une étape ultime chez lesquels les femelles et les mâles sont totalement dépourvus des appendices qui contribuent à la nutrition dans les autres groupes. Ils sont cependant susceptibles de vivre librement dans le plancton marin côtier, en utilisant les réserves constituées au cours de leur développement comme parasite interne de Polychaetes et de Mollusques prosobranches (type de parasitisme dit protélien). Ce groupe est caricatural de la distinction qui fut longtemps pratiquée entre Copépodes libres et parasites, avec toute une série de transitions qui peuvent s'observer dans d'autres ordres.
|